Obtenga una visión general de los tres principales retos asociados al control de infecciones y el reprocesamiento. Descubra también cómo los endoscopios estériles de un solo uso liberan tiempo que, de otro modo, se utilizaría en el reprocesamiento, reducen los riesgos de contaminación cruzada entre pacientes y mejoran la seguridad de los pacientes.
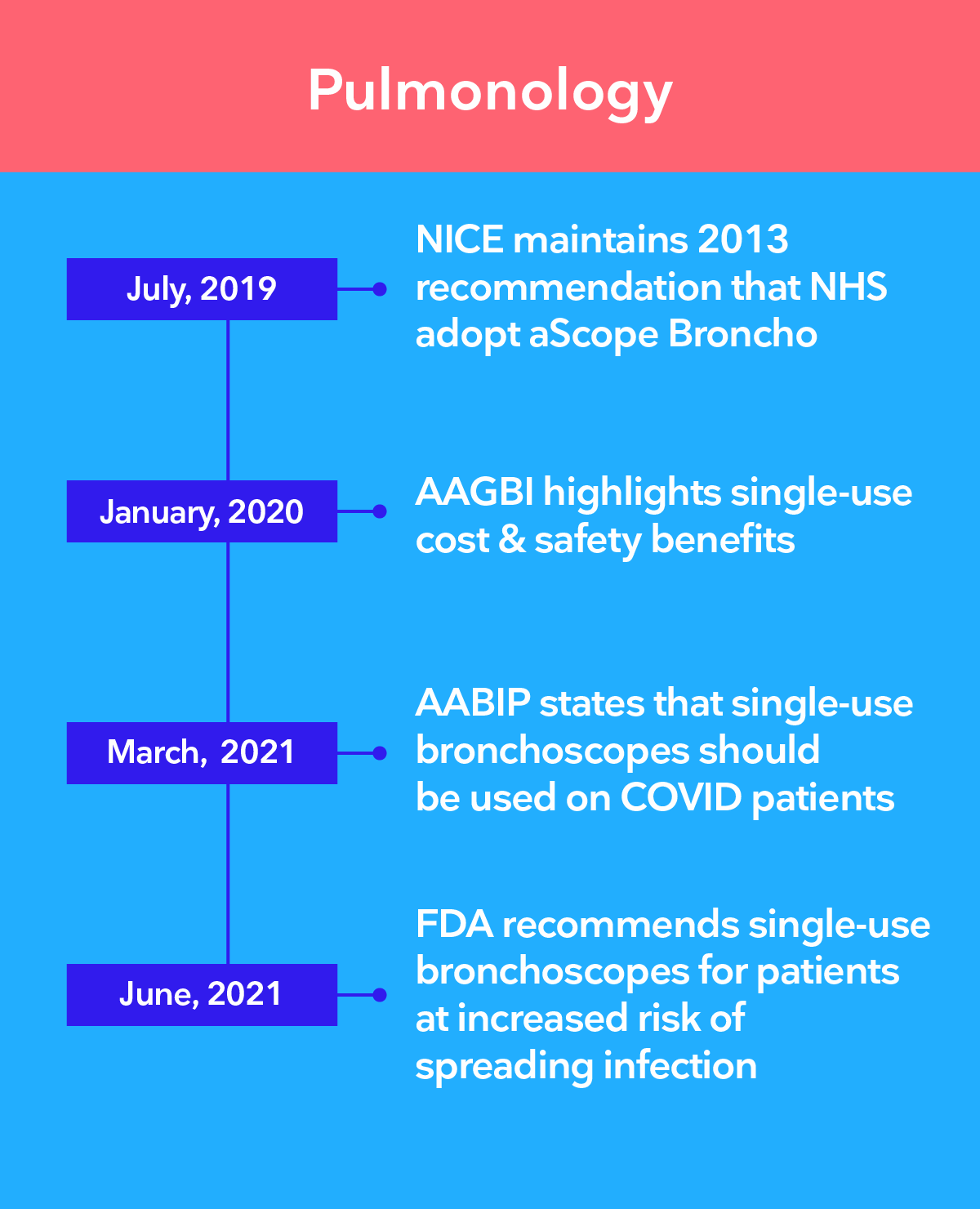
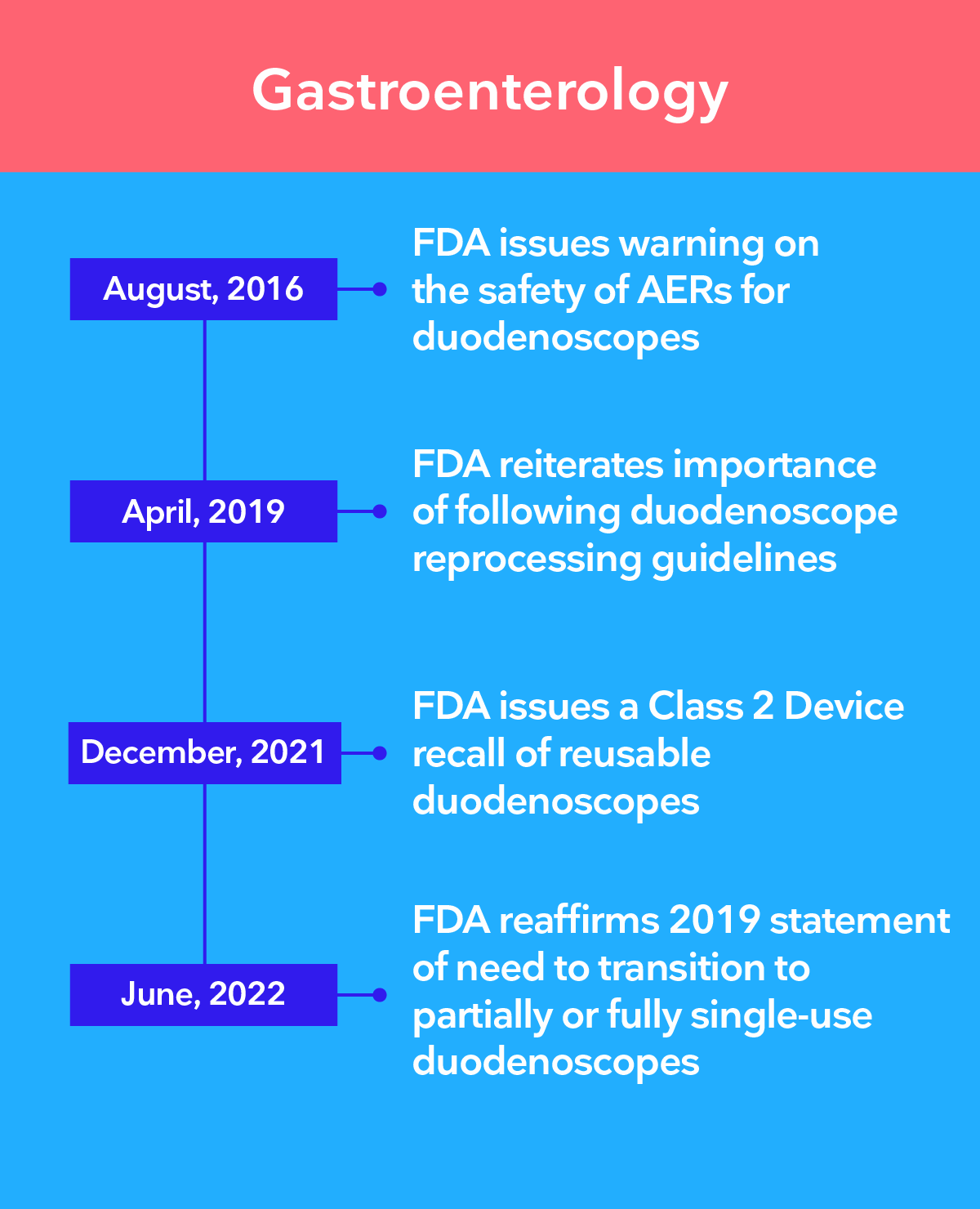
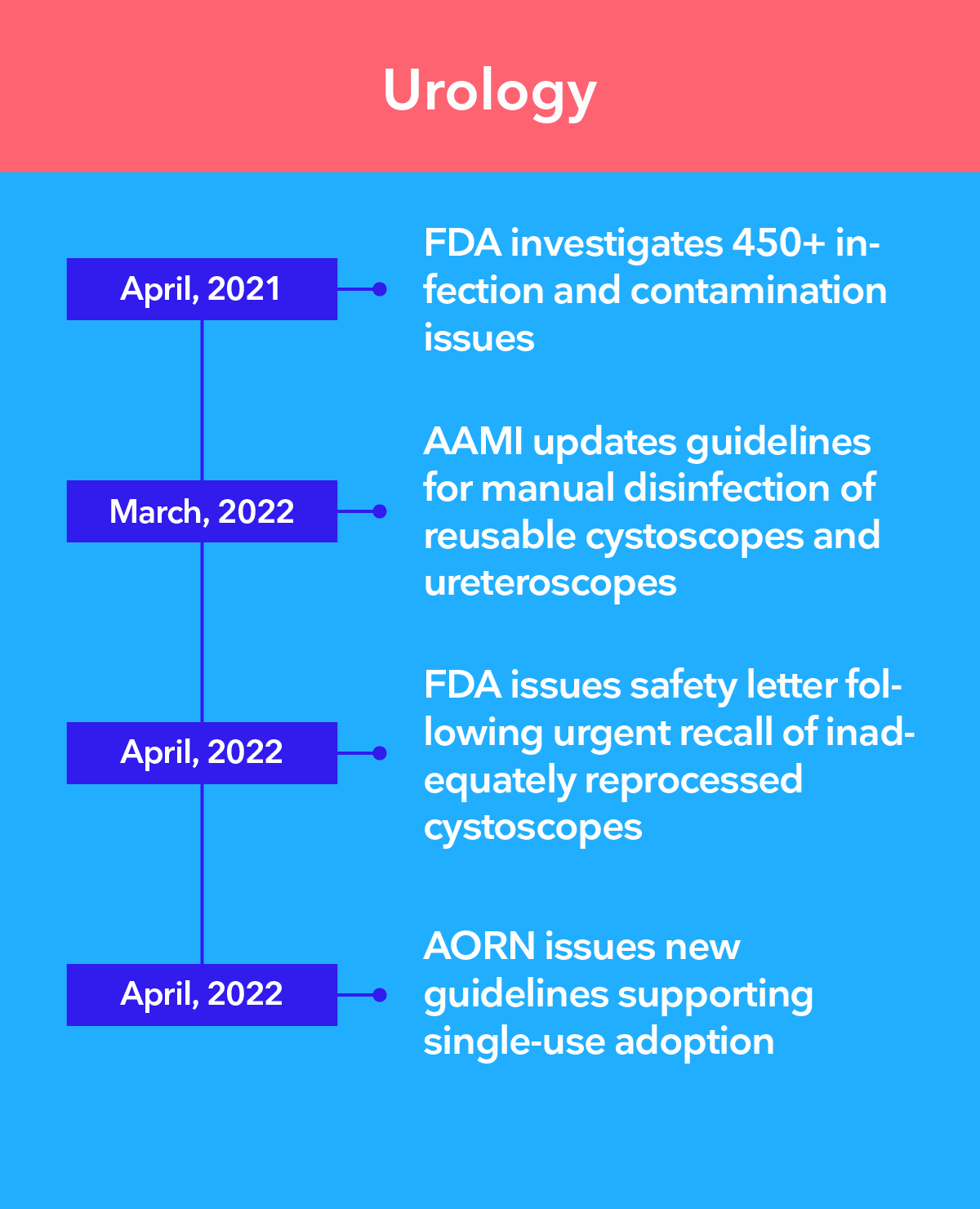
Las principales autoridades recomiendan la transición a la endoscopia de un solo uso
Existe una preocupación creciente de que, incluso con los procedimientos de desinfección de alto nivel más estrictos, no sea posible garantizar que los endoscopios reutilizables estén limpios. Los endoscopios de un solo uso de Ambu® eliminan el riesgo de contaminación cruzada entre pacientes al eliminar por completo el reprocesamiento.
Los tres principales retos relacionados con el control de infecciones en endoscopia
Procesos de limpieza complejos, costosos y, en última instancia, ineficaces
Varios estudios han demostrado que, independientemente de la cantidad de recursos dedicados y de las directrices que se hayan seguido, ningún proceso de limpieza elimina eficazmente las bacterias1-4. Esto es así tanto si el reprocesamiento se ha realizado mediante desinfección de alto nivel (DAN), doble DAN o DAN y esterilización combinadas5-6.
Los siguientes pasos representan una versión condensada de las acciones de reprocesamiento básicas recomendadas. En realidad, puede haber más de 100 pasos7.
Pasos del reprocesamiento:
LIMPIEZA PREVIA
FUNDAMENTAL PARA EVITAR LA FORMACIÓN DE BIOFILM
Importante
Debe realizarse después del procedimiento, con cuidado y siguiendo las instrucciones de uso.
PRUEBA DE FUGAS
DETECCIÓN DE DAÑOS INTERNOS/EXTERNOS
Importante
Los daños pueden provocar una desinfección inadecuada y un deterioro adicional.
LIMPIEZA MANUAL
PASOS MÁS CRÍTICOS PARA LA DESINFECCIÓN
Importante
La limpieza meticulosa es un requisito previo para la DAN y la esterilización.
INSPECCIÓN VISUAL
PARA UNA MAYOR SEGURIDAD CONTRA LAS INFECCIONES
Importante
El diseño complejo de los endoscopios flexibles dificulta la detección de problemas.
DESINFECCIÓN O ESTERILIZACIÓN
FUNDAMENTAL PARA CUMPLIR LO INDICADO EN LAS INSTRUCCIONES
Importante
La FDA recomienda la doble DAN o la esterilización siempre que sea factible.
ALMACENAMIENTO
EN CONDICIONES QUE OFREZCAN PROTECCIÓN FRENTE A LA HUMEDAD
Importante
Un almacenamiento incorrecto puede provocar la proliferación de bacterias.
DOCUMENTACIÓN
ESENCIAL PARA LA GARANTÍA DE CALIDAD Y LA TRAZABILIDAD
Importante
La documentación de los pasos anteriores es necesaria cada vez que se reprocesa un endoscopio.
REPETICIÓN POR PROCEDIMIENTO
UN PROCESO CONTINUO
Importante
Los pasos que se muestran aquí incluyen solo las acciones básicas recomendadas. Un equipo multidisciplinar debería elaborar las directrices individualizadas para cada institución.
Si el margen de seguridad para el reprocesamiento de endoscopios es tan pequeño que se requiere el cumplimiento perfecto de >100 páginas de las instrucciones de uso del fabricante, entonces el diseño del endoscopio es demasiado complejo, la carga microbiana es demasiado alta y el proceso es demasiado rígido para ser práctico en situaciones reales.7
William A. Rutala, PhD, MPHX
Diseño del endoscopio intrínsecamente difícil de limpiar
Los canales largos y estrechos, las zonas de difícil acceso1, 8-9 y el deterioro4-5, 10-11 así como las ranuras formadas debido al uso y la limpieza rutinarios hacen que los endoscopios sean susceptibles a la humedad y la contaminación bacteriana.
Las bacterias pueden residir en los botones remotos, las válvulas del cabezal, las cavidades de la punta distal, el puerto de biopsia y el canal de trabajo de todos los endoscopios. En los endoscopios gastrointestinales, las bacterias también pueden ocultarse en los botones remotos, las válvulas y las ruedas del cabezal, y el complejo diseño del elevador del duodenoscopio es especialmente difícil de limpiar.
De hecho, el ECRI, una organización sin ánimo de lucro dedicada a la seguridad de los pacientes EE.UU., ha incluido la posibilidad de contaminación cruzada y una limpieza inadecuada de los endoscopios en sus listas anuales de ECRI de "10 principales riesgos tecnológicos para la salud" en varias ocasiones.
Lugares en los que los microorganismos se pueden ocultar
- Palanca de inflexión
- Botón de aspiración
- Botón del endoscopio
- Botones remotos, válvulas y ruedas
- Puerto de biopsia
- Punta distal
- Punta distal con elevador
- Canal de trabajo
El auge de las «superbacterias»
El aumento en los últimos años de los organismos resistentes a diferentes fármacos (MDRO), a veces denominados superbacterias, ha hecho que sea aún más difícil limpiar los endoscopios.12-13 Por ejemplo, se han producido más de 15 brotes relacionados con los MDRO desde el año 2000.14
Los endoscopios de un solo uso de Ambu son estériles directamente del envase
Con los endoscopios de un solo uso de Ambu:
El hecho de que ninguno de los endoscopios de un solo uso de Ambu contenga ftalatos, una de nuestras muchas iniciativas medioambientales, también contribuye a la seguridad del paciente.
Más información sobre las ventajas de los dispositivos de un solo uso
Descubra cómo los endoscopios estériles de un solo uso de Ambu proporcionan una alta calidad y rendimiento constantes, ayudan a optimizar el flujo de trabajo y le proporcionan una mayor transparencia de costes en múltiples áreas clínicas.
Learn about Ambu single-use endoscopes for different clinical areas
Referencias
1. Rauwers AW, Voor in ‘t holt AF, Buijs JG, de Groot W, Erler NS, Bruno MJ, Vos MC, Nationwide risk analysis of duodenoscope and linear echoendoscope contamination, Gastrointestinal Endoscopy (2020).
2. Rex DK, Sieber M, Lehman GA, et al. A double-reprocessing high-level disinfection protocol does not eliminate positive cultures from the elevators of duodenoscopes. Endoscopy. 2018;50(6):588-596.
3. Naryzhny I, Silas D, Chi K. Impact of ethylene oxide gas sterilization of duodenoscopes after a carbapenem-resistant Enterobacteriaceae outbreak. Gastrointestinal Endoscopy (2016).
4. Seidelman JL, Akinboyo IC, Taylor B, Henshaw NG, Abdelgadir A, Gray GC, Smith BA, Lewis SS. Pseudo-outbreak of adenovirus in bronchoscopy suite. Infect Control Hosp Epidemiol. 2021 Aug;42(8):1016-1017.
5. Snyder GM, Wright SB, Smithey A, et al. Randomized Comparison of 3 High-Level Disinfection and Sterilization Procedures for Duodenoscopes. Gastroenterology. 2017;153(4):1018-1025.
6. Ofstead Cori L, Quick Mariah R, Eiland John E, et al., 2017: A glimpse at the true cost of reprocessing endoscopes: Results of a pilot project. www.iahcsmm.org. https://www.bostonscientific.com/content/dam/bostonscientific/uro-wh/portfolio-group/LithoVue/pdfs/Sterilization-Resource-Handout.pdf. Accessed May 28, 2023.
7. Kovaleva J. Infectious complications in gastrointestinal endoscopy and their prevention. Best Pract Res Clin Gastroenterol. 2016;30(5):689-704.
8. Rutala WA, Kanamori H, Sickbert-Bennett EE, Weber DJ. What’s new in reprocessing endoscopes: Are we going to ensure “the needs of the patient come first” by shifting from disinfection to sterilization? Am J Infect Control. 2019 Jun;47S:A62–6.
9. Mark J, Underberg K, Kramer R, Results of duodenoscope culture and quarantine after manufacturer-recommended cleaning process, Gastrointestinal Endoscopy (2020).
9. Gavalda L, Olmo Ana Rosa, Hernandez R, etal., Hospital Bronchoscopy Quality Improvement Group. Respiratory Medicine (2015) 109, 1079-1085.
10. Ofstead CL, Wetzler HP, Heymann OL, Johnson EA, Eiland JE, Shaw MJ. Longitudinal assessment of reprocessing effectiveness for colonoscopes and gastroscopes: Results of visual inspections, biochemical markers, and microbial cultures. Am J Infect Control. 2017;45(2):e26-e33.
11. Barakat MT, Girotra M, Huang RJ, Banerjee S. Scoping the scope: endoscopic evaluation of endoscope working channels with a new high-resolution inspection endoscope (with video). Gastrointest Endosc. 2018;88(4):601-611.e1.
12. Mehta AC, Muscarella LF. Bronchoscope-Related "Superbug" Infections. Chest. 2020 Feb;157(2):454-469
13. US. Food and Drug Administration. Flexible Bronchoscopes and Updated Recommendations for Reprocessing: FDA Safety Communication. FDA Web site. https://www.fda.gov/medical-devices/safety-communications/flexible-bronchoscopes-and-updated-recommendations-reprocessing-fda-safety-communication. Published 2021. Accessed May 28, 2023.
14. Rubin ZA, Kim S, Thaker AM, Muthusamy VR. Safely reprocessing duodenoscopes: current evidence and future directions. Lancet Gastroenterol Hepatol. 2018;3(7):499-508.











